5月19日,我校第一附属医院泌尿外科梁朝朝教授团队在《军事医学研究(Military Medical Research)》(中科院一区Top,IF=16.7),发表题为《高盐饮食通过诱导肠道菌群失调进而促进AHR/SGK1/FOXO1轴介导的Th17细胞分化加重前列腺炎(High-salt-driven gut microbiota dysfunction aggravates prostatitis by promoting AHR/SGK1/FOXO1 axis-mediated Th17 cell differentiation)》的研究论文。我校第一附属医院泌尿外科主治医师陈晶、硕士研究生冯锐、副主任医师龚宾宾为本论文的共同第一作者,我校首届“徐叔云讲席教授”、国家杰出医师、第一附属医院泌尿外科梁朝朝教授为本论文的通讯作者,研究员张力、主任医师杨诚为本论文的共同通讯作者。我校第一附属医院为第一完成单位。
慢性前列腺炎/慢性盆腔疼痛综合征(chronic prostatitis/chronic pelvic pain syndrome, CP/CPPS)是泌尿男科常见疾病,流行病学数据显示约35%-50%的男性在其一生中会受此疾病困扰。该病以长期反复发作的下尿路症状(排尿异常)和慢性盆腔疼痛为典型临床表现,还可能引发勃起功能障碍、男性不育以及焦虑、抑郁等精神心理症状,严重影响患者身心健康和生活质量,造成了承重的社会负担。目前CP/CPPS的病因与发病机制仍不清楚,缺乏有效的干预措施。临床常规治疗方案(包括抗生素使用、α受体阻滞剂等药物干预)效果不佳,导致疾病治愈率低、复发率高。
钠离子作为维持细胞生理功能的重要电解质,其代谢平衡对机体免疫稳态维持具有重要的调控作用。既往研究显示,高盐饮食(high-salt diet, HSD)可通过特异性诱导Th17细胞分化并促进其分泌IL-17等促炎因子,从而加剧溃疡性结肠炎、自身免疫性脑脊髓炎等多种免疫相关性疾病的进展。然而,关于HSD是否促进CP/CPPS的发生发展以及其中的关键调控机制,目前尚未见相关研究报道。
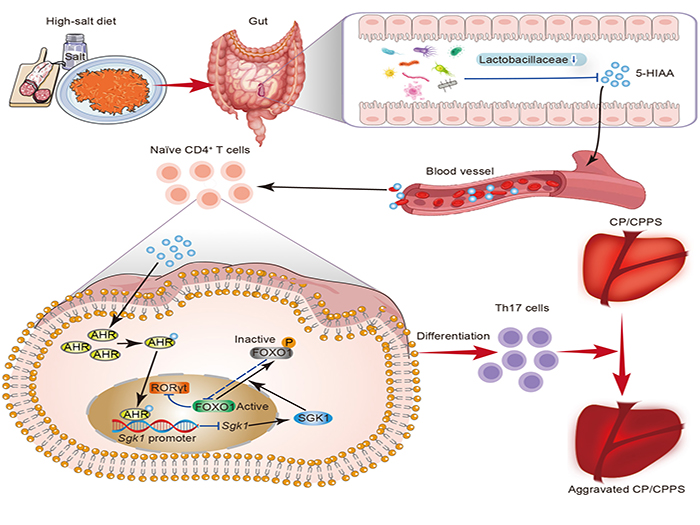
该研究通过构建“膳食-菌群-免疫”轴在CP/CPPS中的系统研究框架,首次揭示了 HSD通过重塑“肠道微生态-宿主代谢”互作网络驱动Th17免疫失衡的新机制。通过多组学整合分析发现HSD暴露可显著诱导肠道菌群结构重塑,其特征性改变表现为乳酸杆菌丰度降低,并伴随其关键循环代谢产物5-羟基吲哚乙酸(5-HIAA)的水平下降。这种菌群-代谢物轴紊乱直接解除了5-HIAA对Th17细胞分化的生理性抑制,使前列腺局部Th17细胞浸润增加,IL-17A等促炎因子表达显著上调,最终导致CP/CPPS病理损伤加重。机制解析方面,该研究发现5-HIAA作为内源性芳香烃受体(AHR)配体,可通过与血清/糖皮质激素调节激酶1(SGK1)基因启动子的结合抑制SGK1转录。
该研究提出的“5-HIAA-AHR-SGK1”调控轴从表观遗传层面阐释了菌群代谢物调控Th17分化的分子开关机制,为理解CP/CPPS的免疫失调提供了全新理论范式。该研究不仅证实了高盐饮食是CP/CPPS的重要风险因素,更为CP/CPPS的菌群靶向治疗和代谢干预提供了理论依据,为临床防治这一难治性疾病提供了新思路。
我校第一附属医院梁朝朝教授团队长期致力于CP/CPPS发病机制及治疗的研究,在多项国家级课题的资助下,先后在《英国国际泌尿外科学杂志(BJU International)》《泌尿外科学杂志(Journal of Urology)》《前列腺(The Prostate)》《国际生物学杂志(International Journal of Biological Sciences)》《细胞通讯和信号转导(Cell Communication and Signaling)》《自由基生物学与医学(Free Radical Biology & Medicine)》等专业期刊发表论文多篇。
该研究得到了国家自然科学基金面上项目、国家自然科学基金青年科学基金项目(C类)、安徽省自然科学基金青年科学基金项目(B类)等项目的资助。(第一附属医院泌尿外科)


