7月24日,我校生物医学工程学院钱海生教授团队在国际知名期刊《美国化学会-纳米(ACS Nano)》(IF=16.0,中科院一区Top),发表题为《甲基丙烯酰明胶穿刺植入剂负载Cu0.5Mn2.5O4纳米颗粒协同铜死亡和STING激活增强乳腺癌免疫治疗(Gelatin Methacryloyl Xerogel Puncture Implants Loaded with Cu0.5Mn2.5O4 Nanoparticles Synergizes Cuproptosis and STING Activation for Enhanced Breast Cancer Immunotherapy)》的学术论文,为穿刺植入递送药物和三阴性乳腺癌的免疫治疗提供新的实用策略。我校博士研究生蒋业春为论文的第一作者,徐令令副教授和钱海生教授为共同通讯作者,我校为唯一作者单位。
抗肿瘤免疫治疗通过激活或增强患者的免疫系统来精确地攻击肿瘤细胞,是一种革命性的肿瘤内源性治疗理念。然而,免疫治疗对于像乳腺癌这样的免疫抑制实体瘤仍然表现出较差的临床反应。这种免疫抑制生态位可以通过多种途径扭转,T细胞在这一过程中起着核心作用。T细胞的持续激活依赖于cGAS-STING通路的激活,该通路不仅在先天免疫中很重要,而且是适应性免疫反应的关键调节器。传统的外源性STING激动剂在临床应用中存在明显的局限性:一方面,带负电荷的分子结构阻碍了有效穿透细胞膜,导致细胞内递送效率不理想;另一方面,核酸酶的快速降解结合网状内皮系统介导的非特异性清除机制显著降低了治疗药物的体内半衰期。
该项研究表明,核膜完整性的破坏或线粒体功能障碍,导致dsDNA的泄漏,是触发先天免疫的关键内源性信号。这些内源性dsDNA分子与cGAS蛋白的正电荷结构域静电相互作用,诱导cGAS的构象变化。这导致一系列生化反应和信号级联反应,最终驱动I型干扰素的表达。因此,通过激活dsDNA的释放并结合免疫治疗成为一种值得探索的策略。
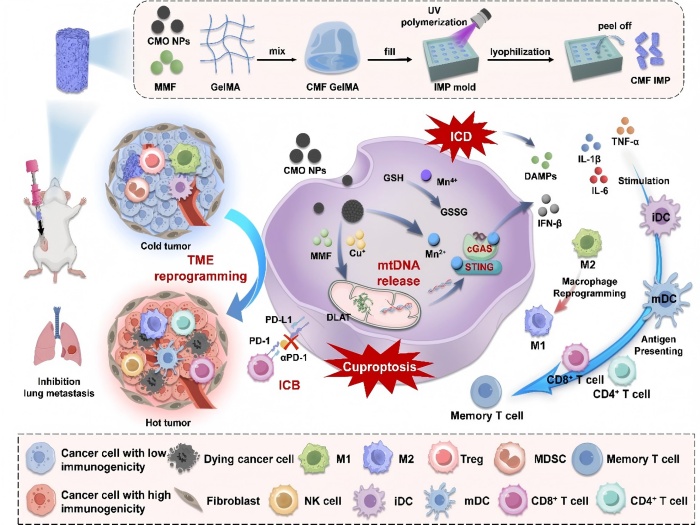
钱海生教授团队在临床活检取样的启发下,开发了一种基于穿刺针输送的可降解肿瘤植入剂。植入剂由光交联的甲基丙烯酰明胶作为底物,可以有效装载Cu0.5Mn2.5O4纳米颗粒(CMO NPs)和富马酸单甲基(MMF)。在体内,植入剂在金属基质蛋白酶的作用下逐渐降解并缓慢释放药物。植入剂中加载的CMO NPs诱导癌细胞铜死亡并与MMF协同触发线粒体损伤,促进mtDNA释放。释放到细胞质中的mtDNA随后通过与Mn2+配合激活cGAS-STING通路,触发先天免疫应答。此外,CMO NPs通过诱导免疫原性细胞死亡(ICD)释放损伤相关的分子模式(DAMPs),并促进树突状细胞(DC)成熟。cGAS-STING介导的先天免疫与ICD激活的适应性免疫协同作用,显著增加肿瘤微环境中CD8+T细胞浸润及相关炎症因子水平。在动物实验中,CMO NPs通过调整肿瘤组织中PD-1和PD-L1的水平显示出与antiPD-1的协同治疗作用。
该研究工作得到了国家自然科学基金、安徽省自然科学基金、安徽省教育厅自然科学基金的资助。(生物医学工程学院)


