8月12日,我校第一附属医院医学影像科王啸教授团队在国际期刊《先进复合材料和混合材料(Advanced Composites and Hybrid Materials)》(中科院一区Top,IF = 21.8)发表题为“超声激活双纳米酶平台实现肝纤维化治疗中ROS清除与NO靶向递送(Ultrasound-activated dual-nanozyme platform for targeted ROS scavenging and NO delivery in liver fibrosis therapy)”的研究论文。我校博士研究生尹秀娟为论文第一作者,王啸为最后通讯作者,药学科学学院教授张磊、广州医科大学副研究员李愿为论文共同通讯作者,我校为第一作者单位。
该项研究创新性地构建了一种超声响应型双纳米酶平台(UVLp),首次将超声激活、双纳米酶催化、靶向递送及一氧化氮(NO)治疗策略高效集成,成功实现了对肝纤维化进程中活性氧(ROS)清除与细胞外基质(ECM)重塑的协同干预,为这一临床难治性疾病的防治提供了极具前景的新思路和新方法。
肝纤维化是肝损伤后自我修复的慢性动态可逆病理过程,是发展成肝硬化和肝癌的必经阶段,目前临床缺乏有效逆转手段。针对纤维化肝组织中活性氧(ROS)过度累积这一核心机制,王啸教授团队成功开发了一种新型超声响应型双纳米酶系统(UVLp),由UiO-66和V₂C纳米酶构成,负载L-精氨酸(L-Arg)并修饰靶向肽pPB,可特异性识别并富集于活化的肝星状细胞(aHSCs)。在超声(US)激活下,纳米酶催化效率显著提升,同步实现高效ROS清除和一氧化氮(NO)可控释放。所产生的NO转化为过氧亚硝酸盐(ONOO⁻),可激活基质金属蛋白酶(MMPs),促进过度沉积的细胞外基质(ECM)降解。
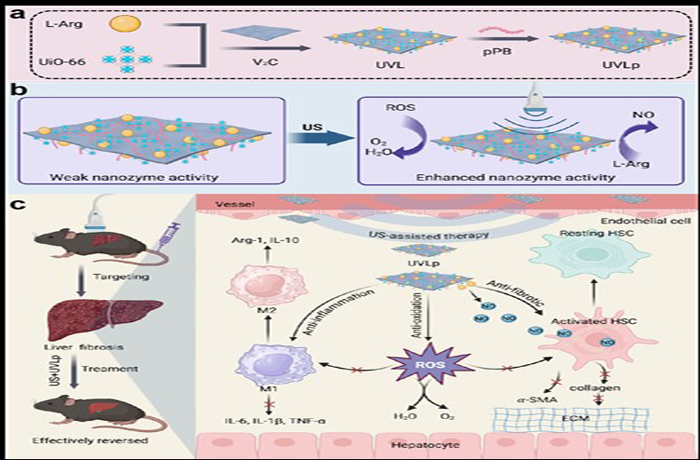
研究表明,US+UVLp显著降低aHSCs的α-SMA和胶原表达,并诱导巨噬细胞向抗炎表型极化。在肝纤维化小鼠模型中,治疗组肝脏炎症和纤维化显著减轻,肝功能指标及炎症因子水平明显改善。机制解析方面,UVLp通过协同抑制PI3K/AKT、TGF-β等多条纤维化相关信号通路发挥作用。进一步研究显示UVLp具备良好的生物相容性,为肝纤维化提供了高效、低毒的潜在临床治疗策略。
该研究得到了国家自然科学基金、安徽省高校重大科研项目等资助。(第一附属医院医学影像科)
原文链接:https://link.springer.com/article/10.1007/s42114-025-01411-0


